Mengapa atom atom
memiliki kecenderungan untuk berikatan? Karena setiap atom ingin memiliki
elektron terluar yang stabil seperti gas mulia. Hal ini disebabkan karena Unsur
– unsur golongan gas mulia ( golongan VIII A) yaitu He
(Helium), Ne (Neon), Ar (Argon), Kr (Kripton), Xe (Xenon), dan Rn (Radon) bersifat stabil
sehingga disebut mulia. Karena sifat stabilnya, unsur-unsur Gas Mulia ini dapat berdiri
sendiri, ditemukan di alam dalam bentuk monoatomik dan jarang sekali ditemukan
dalam bentuk senyawa. Unsur unsur gas mulia hampir tidak membentuk ikatan
dengan atom lain dan karena tidak reaktifnya maka sering disebut juga sebagai gas inert. Pertanyaannya adalah mengapa bisa
terjadi hal demikian pada unsur golongan gas mulia?
Pada
Tahun 1916 G.N. Lewis dan W. Kossel menjelaskan hubungan kestabilan gas mulia
dengan konfigurasi elektron. unsur-unsur gas mulia mempunyai 8 elektron valensi
(setiap orbital elektronnya terisi penuh/berpasangan) sehingga gas mulia
bersifat stabil. Kecuali He; mempunyai 2 elektron valensi.
2He4 :
2
10Ne20 :
2 8
18Ar40
: 2 8 8
36Kr84
: 2 8
18 8
54Xe131
: 2 8
18 18 8
86Rn(222):
2 8 18
32 18 8
Unsur – unsur lain cenderung mengikuti gas mulia untuk
mencapai kestabilan. Atom-atom lain agar stabil berusaha memiliki
konfigurasi elektron seperti gas mulia. Kecenderungan ini bisa terjadi dengan
membentuk ikatan kimia antar atom yang satu dengan atom lainnya. Apabila suatu
atom mencapai
kestabilan dengan 2 elektron valensi menyerupai unsur He maka disebut sebagai kaidah
duplet. Sedangkan suatu atom yang mencapai kestabilan dengan 8 elektron valensi
maka disebut sebagai kaidah Oktet.
Ikatan Ion
Ikatan
ini terjadi ketika ada perbedaan tendensi yang sangat besar dari atom untuk melepas
atau menangkap elektron. Atom-atom yang melepas
elektron menjadi ion positif (kation) sedang atom-atom yang menerima elektron
menjadi ion negatif (anion). Perbedaan yang sangat mencolok terjadi
antara logam alkali yang reaktif (golongan IA) dan non logam, golongan halogen
(golongan VII A). Atom logam dengan harga ionisasi yang rendah mudah melepaskan
elektron valensinya, sementara atom non logam dengan afinitas elektron yang
besar (elektronegatif) dengan mudah menangkap elektron
Keadaan
ini menyebabkan terjadinya transfer elektron antara logam dan non logam
membentuk ion menyerupai konfigurasi gas mulia.
Misalnya,
pada Ikatan NaCl, atom Na yang tidak stabil melepaskan satu elektron valensinya
menjadi ion Na+ dengan menyerupai konfigurasi elektron seperti atom neon
(10Ne).
11
Na : 2
8 1
11 Na+
: 2 8
Sementara atom
Cl menerima tambahan satu elektron, sehingga menjadi ion Cl- dengan
konfigurasi elektron seperti konfigurasi elektron Argon (18Ar).
17
Cl : 2
8 7
17 Cl-
: 2 8
8
Ketika atom natrium melepaskan sebuah elektron valensinya sehingga
terjadi ion natrium, Na+ dan elektron ini diterima oleh atom klor sehingga
terjadi ion klorida, Cl-. ion klorida dan ion natrium saling tarik
menarik dengan gaya elektrostatis sehingga terjadi ikatan ion yang menghasilkan
senyawa ionik NaCl.
Sifat-sifat
fisika senyawa ionik pada umumnya:
1. pada
suhu kamar berwujud padat
2.
struktur kristalnya keras tapi rapuh
3.
mempunyai titik didih dan titik leleh tinggi
4.
larut dalam pelarut air tetapi tidak larut dalam pelarut organik
5.
tidak menghantarkan listrik pada fase padat, tetapi pada fase cair (lelehan)
dan larutannya menghantarkan listrik
Ikatan Kovalen
Ikatan kovalen adalah
ikatan yang terbentuk karena pemakaian bersama dua elektron oleh dua atom.
Pertanyaannya adalah kenapa dua atom saling berbagi elektron ? Pasalnya tidak
seperti ikatan ionik, dalam ikatan kovalen hanya terjadi perbedaan kecil pada
tendensi untuk melepas atau menangkap elektron sehingga terjadi sharing
elektron. ikatan ini umum terjadi antar atom non logam. Tiap-tiap atom non
logam mempertahakan elektron masing masing dan mencoba menarik elektron atom
lain. Gaya tarik masing-masing atom terhadap elektron valensi lawannya membuat
kedua atom berikatan. Ikatan kovalen terjadi karena
pemakaian bersama pasangan elektron (Sharing electron pair) oleh atom-atom yang
berikatan. Pasangan elektron yang dipakai bersama disebut pasangan elektron ikatan
(PEI) dan pasangan elektron valensi yang tidak terlibat dalam pembentukan
ikatan kovalen disebut pasangan elektron bebas (PEB). Pasangan elektron
sharing (dipakai bersama) dianggap elektron yang terlokalisasi diantara kedua
atom sehingga menjadi milik bersama.
Atom-atom
yang sama atau hampir sama keelektronegatifannya cenderung membentuk ikatan
kovalen dengan menggunakan pasangan elektron bersama. Hampir semua senyawa
kovalen terbentuk dari atom-atom non-logam seperti H2, Cl2,
O2, NH3, CH4, CO2 dan lain
sebagainya. Dua atau lebih atom nonlogam saling menyumbangkan elektron sehingga
tersedia satu atau lebih pasangan elektron yang dijadikan milik bersama.
Sebagai contoh Atom hidrogen memiliki sebuah elektron pada kulit pertamanya, agar
konfigurasi elektronnya penuh seperti gas mulia helium (2He) maka hidrogen
memerlukan satu elektron lagi. Gas hidrogen yang merupakan molekul H2 terdiri
dari dua atom hidrogen yang saling menyumbangkan elektronnya sehingga
masing-masing atom hidrogen memiliki konfigurasi elektron yang stabil.
Contoh
lain adalah pada ikatan molekul H2O. Atom oksigen yang mempunyai 6 elektron
valensi membutuhkan 2 elektron lagi agar seperti gas mulia. Kedua elektron itu
diperoleh dari dua atom hidrogen. Jadi atom oksigen dapat membentuk dua ikatan
kovalen dalam molekul H2O.
8O :
2 6
1H :
1
Ikatan
Kovalen itu bermacam-macam jenisnya, apabila dilihat dari pasangan elektron
ikatannya, ikatan kovalen dibagi menjadi ikatan kovalen tunggal, Ikatan kovalen
rangkap (double bond ) dan ikatan rangkap tiga (triple bond). Pada ikatan
kovalen tunggal mengandung dua elektron (contoh pada molekul H2),
ikatan kovalen rangkap dua mengandung empat elektron seperti Pada molekul
oksigen, O2 terdapat dua buah ikatan (double bond) Kedua atom oksigen masing masing
memiliki 8 elektron valensi. Sedangkan dalam ikatan rangkap tiga terdapat enam
elektron. Contohnya seperti pada molekul nitrogen, N2 setiap atomnya
menyumbangkan 3 elektron untuk digunakan bersama sama sehingga setiap atom N
memiliki elektron valensi 8.
Sementara
apabila ditinjau dari kepolaran ikatan, maka ikatan kovalen dibedakan menjadi
ikatan kovalen polar dan Non Polar.
Ikatan kovalen polar adalah ikatan kovalen dengan pasangan
elektron ikatannya cenderung tertarik ke salah satu atom yang berikatan.Kepolaran
suatu ikatan kovalen ditentukan oleh keelektronegatifan suatu unsur. Senyawa
kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya
besar dan mempunyai bentuk molekul yang tidak simetris, serta memiliki harga
momen dipol yang lebih besar dari nol. Harga momen dipol merupakan hasil kali
beda keelektronegatifan dengan jarak ikatan.
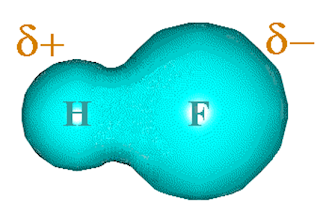
Contoh, pada molekul hydrogen fluorida HF. Atom H cenderung
tertarik kearah atom F karena atom F lebih elektronegatif. Perbandingan
kelektronegatifan H:F adalah 2.1 : 4.0 sehingga menyebabkan bentuk molekul
menjadi tidak simetris atau terjadi polarisasi (membentuk kutub positif dan
negatif).
Sementara
pada Ikatan kovalen nonpolar yaitu ikatan kovalen
yang pasangan elektron ikatannya tertarik sama kuat ke arah atom-atom yang
berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang
mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau
mempunyai bentuk molekul simetri. Contohnya seperti pada molekul H2.
Tidak
semua ikatan kovalen yang terjadi, elektron-elektronnya diperoleh dari
sumbangan atom-atom yang membentuk ikatan. Beberapa molekul ada yang pasangan
elektronnya berasal dari salah satu atom saja, sedang atom lainnya menggunakan
pasangan elektron
itu
untuk berikatan. Hal ini terjadi seperti pada Molekul NH3 yang mempunyai satu
pasang elektron yang belum digunakan bersama, sedang ion H+ dapat
menerima satu pasang elektron untuk menjadi lebih stabil karena mempunyai konfigurasi
elektron helium. Oleh karena itu pasangan elektron tersebut dapat digunakan
bersama oleh molekul NH3 dan ion H+ sehingga terbentuk ion amonium,
NH4+. Ikatan antara NH3 dengan ion H+ ini juga merupakan
ikatan kovalen yang diberi nama ikatan kovalen
koordinasi.
Contoh
lain terjadi pada molekul SO3 atom Sulfur, 16S : 2 8 6
memiliki 6 elektron Valensi, 2 buah elektron digunakan untuk berikatan rangkap
dengan 1 atom O dan 2 pasang elektron lagi disediakan untuk 2 buah atom O yang
lain, karena atom O memiliki elektron valensi 6 dan memutuhkan 2 elektron,
sehingga atom O dapat menerima sepasang elektron dari atom S. Dengan demikian
terdapat 2 buah ikatan kovalen koordinasi dan keempat atom memiliki elektron valensi 8 yang stabil.
Ikatan
Logam
Drude
dan Lorentz mengemukakan model, bahwa logam sebagai suatu kristal terdiri dari
ion-ion positif logam dalam bentuk bola-bola keras dan sejumlah elektron yang
bergerak bebas dalam ruang antara. Elektron-elektron valensi logam tidak
terikat erat (karena energi ionisasinya rendah), sehingga elektron relatif lebih
bebas bergerak. Hal ini dapat dimengerti mengapa logam bersifat sebagai
penghantar panas dan listrik yang baik, dan juga mengkilat. Suatu model logam
dengan elektron-elektron membentuk suatu “lautan” muatan negatif dapat dilihat
seperti gambar berikut :
Model
lautan elektron ini sesuai dengan sifat-sifat logam, seperti: dapat ditempa
menjadi lempengan tipis, ulet karena dapat direntang menjadi kawat, memiliki
titik leleh dan kerapatan yang tinggi. Logam dapat dimampatkan dan direntangkan
tanpa patah karena atom-atom dalam struktur kristal harus berkedudukan sedemikian
rupa sehingga atom-atom yang bergeser akan tetap pada kedudukan yang sama. Hal
ini disebabkan mobilitas lautan elektron di antara ion-ion positif meru-pakan
penyangga.
Sebagai Contoh terjadinya ikatan logam besi Fe, Pada Tempat kedudukan
elektron valensi dari suatu atom besi (Fe) dapat saling tumpang tindih dengan
tempat kedudukan elektron valensi dari atom-atom Fe yang lain. Tumpang tindih
antarelektron valensi ini memungkinkan elektron valensi dari setiap atom Fe
bergerak bebas dalam ruang di antara ion-ion Fe+ membentuk lautan elektron.
Karena muatannya berlawanan (Fe2+ dan 2 e–), maka terjadi gaya tarik-menarik
antara ion-ion Fe+ dan elektron-elektron bebas ini. Akibatnya terbentuk ikatan ikatan logam Fe.

.png)
.png)
.png)
.png)
.png)
.png)

.png)
.png)
.png)


.png)

.bmp)






0 comments:
Post a Comment